Химические свойства минералов
Простые химические и физико-химические исследования, с помощью которых устанавливается качественный и количественный химический состав минералов, весьма многообразны. Уже такое свойство, как растворимость, позволяет разделить мир минералов на трудно-и легкорастворимые минералы. При определении минералов по внешним признакам часто применяются простые химические испытания кислотами. Минеральное вещество, превращенное в порошок, растворяется или разлагается в кислотах. Раствор может быть бесцветным, окрашенным или мутным. Очень часто в сосуде остается нерастворимый осадок.
Под действием реагента нередко выпадает хлопьевидный осадок. При этом наблюдается характерное окрашивание, особенно типичное в тех случаях, когда мы имеем дело с металлическими соединениями. Таким простым способом можно обнаружить соединения железа, никеля, меди, кобальта и др. Известен ряд качественных и полуколичественных реакций, в том числе окрашивание пламени (бунзенов-ской горелки), поведение минерального вещества при прокаливании в горячей части пламени, в закрытой или открытой стеклянной трубочке. Так, если в минерале присутствует кристаллизационная вода, как, например, в гипсе, влага в виде капель собирается в холодной части сосуда. Некоторые минералы, особенно сульфиды, при обжиге выделяют вонючие пары двуокиси серы. Мышьяксодержащие минералы (лёллингит, арсенопирит) образуют в стеклянной трубочке металлическое зеркало. Аналогично ведут себя сульфиды, содержащие сурьму. Однозначно определяются также капельки ртути на стенках стеклянной трубочки, когда этим способом исследуются минералы, содержащие ртуть.
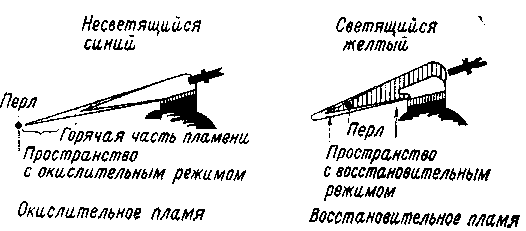
Дальнейшие диагностические возможности предоставляют реакции плавления с помощью паяльной трубки на древесном угле с добавкой буры, соды и др. Прежде всего таким путем определяют рудные минералы, которые при плавлении оставляют специфический металлический королек или образуют некоторые химические соединения. При испытании других рудных минералов на угле в качестве продукта реакции возникает белый или цветной (обычно пылеватый) налет.
Контроль реакции плавления производится обычно следующим образом. Если поместить паяльную трубку в пламя и вдувать воздух, то возникает острое длинное синее несветящееся окислительное пламя. Если паяльную трубку держат возле пламени, так что пламя при дутье отклоняется в сторону, то пламя остается светящимся желтым — это восстановительное пламя. Раскаленный свободный углерод восстанавливает пробу минерала, когда она охвачена светящейся частью пламени.
К числу методов реакций плавления относится также сплавление минеральных веществ в стекловатые перлы с применением буры или соды, благоприятствующих процессу плавления. Такой способ особенно эффективен в случае тугоплавких минералов. К этим методам относится применяемый на протяжении нескольких столетий анализ с помощью паяльной трубки. Здесь не упоминаются современные детальные химико-аналитические методы, применяемые в научных лабораториях, где производится полный химический анализ минералов и определение элементов-примесей.
находится в рубрике: Общие вопросы о минералах.